|
L’armillaire est un champignon Basidiomycète Agaricale,
responsable d’un pourridié « pourridié agaric »
sur la plus part des végétaux ligneux (C.T.G.R.E.F., 1980 &
GUILLAUMIN, 1985).
Des travaux de
GUILLAUMIN. et BERTHELAY, 1981 et RISHBETH, 1982 (in GUILLAUMIN,
1985) ont montré qu’il existe de différentes espèces
d’armillaire qui diffèrent par de nombreux caractères (répartition
géographique, écologie, pouvoir pathogène etc.).
L’armillaire se développe
surtout sur les arbres affaiblis, carencés ou attaqués par des
insectes et exceptionnellement sur les arbres bien venants.
L’armillaire est fréquemment
observé sur des arbres dépérissants où morts. Il apparaît
donc que ce champignon, composant normal de la flore mycologique
des chênaies, modifie son comportement et devient parasite
lorsque les arbres sont affaiblis (GUILLAUMIN. et al. 1984).
|
|
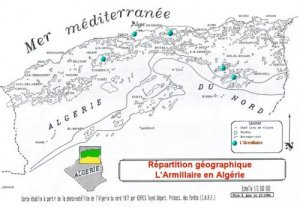
Répartition
géographique:
L’armillaire est
signalé en Australie, en Afrique et en Europe (LANIER, 1986a).
Elle se retrouve surtout le pourtour méditerranéen et ce
comporte en parasite de faiblesse sur les racines (LANIER, 1986b).
En Algérie l’Armillaria
mellea a été signalé sur cèdre de l’Atlas dans la forêt
de Belezma (Aurès) (ANSELMI, 1984), des forêts du Parc National
de Chréa (Blida), et Parc National de Teniet-El-Had (Ouarsenis)
(LANIER, 1986b), et a été retrouvé sur chêne zeen et chêne liège
dans la forêt de Baïnem par l’Équipe de pathologie du Département
de Protection des Forêts. (I.N.R.F.).
|
|
|
|
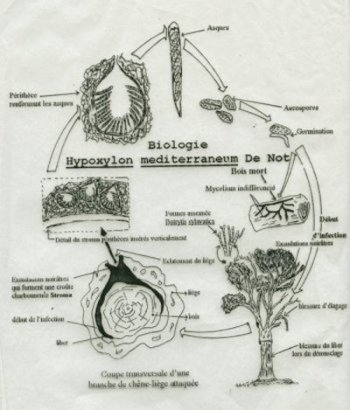
Biologie
(voir
schéma  d’après SAI, 1997).
d’après SAI, 1997).
Les carpophores
apparaissent en touffe à l’automne au pied des arbres morts ou
à proximité et ou sur des souches en décomposition.
Germination des basidiospores
qui donne des mycélium indifférenciés
Ce
mycélium va se différencier dans le sol en Rhizomorphes
souterrains en forme de lacets noirs qui vont se croître
dans le sol et infecter d’autres racines. La propagation d’un
arbre à un autre se fait par le contacte des racines malades et
des racines saines (C.T.G.R.E.F., 1980; GUILLAUMIN, 1985 &
SAI, 1997).
Ces Rhizomorphes
souterrains naissent au niveau des collets des Rhizomorphes
sous corticaux que l’on découvre soulevant l’écorce, de
formes aplatis, blancs à bruns en vieillissants plus au moins
ramifiés qui forme un mycélium blanc (aspect de peau de chamois)
(C.T.G.R.E.F., 1980).
|
Les carpophores



basidiospores
Rhizomorphes
Mycélium
sous corticaux |
|
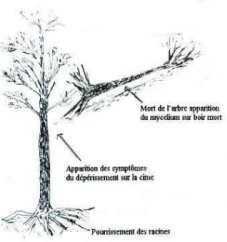
Dégâts
On
constate :
1.
Un dessèchement de l’arbre commençant par la cime puis
les extrémités des branches qui est plus caractérisé en fin
d’été,
2.
L’écorce se détache facilement, dans le cas des résineux
le collet se couvre de résine.
3.
Une pourriture des racines ce qui perturbe l’alimentation
de l’arbre.
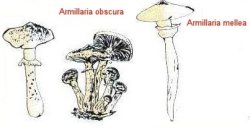
L’Armillaria
mellea peut être pathogène primaire chez les feuillus, pathogène
secondaire chez les résineux que l’Armillaria obscura
ou ostoyae peut être pathogène primaire chez les
résineux, pathogène secondaire chez les feuillus (D.S.F., 1990).
|
|
|
|
Symptômes
et éléments de diagnostic
·
Des dépérissements en taches circulaires;
·
Des champignons à chapeau et à lamelles (Carpophores),
apparaissent en touffes en automne au pied des troncs;
·
S’il n’y a pas de fructification, il faut regarder sous
l’écorce à la base du tronc , s’il n’y aurait pas des
coussinets de mycélium blanc traversé de cordons en forme de
lacets de souliers (Rhizomorphes) qui se présentent sous
deux formes (C.T.G.R.E.F.,
1980):
1.
Rhizomorphes
sous-corticaux,
aplatis, bruns plus au moins ramifiés ;
2.
Rhizomorphes
souterrains
dans le sol plus au moins cylindriques noirs;
Méthode
de lutte et recommandations
Le parasite attaquant
les parties souterraines il est particulièrement difficile de
lutter contre ses méfaits. Deux types de mesures peuvent être
envisagées, les mesures préventives essentiellement sylvicoles
et les mesures curatives d’après SAI et CHAIBEDDRA (1996):
a)
Mesures préventives :
Le parasite étant
plus actif quand les conditions physiologiques de l’arbre, sont
mauvaises, il faut donc:
·
Pratiquer des éclaircies.
·
Éviter les blessures.
·
Enlever les arbres morts.
·
Dans les peuplements artificiels, il ne faut introduire que
les essences convenant parfaitement aux conditions locales. Les
plants doivent être sains et vigoureux.
·
Quand cela est possible mélanger les essences (feuillues
et résineuses) puisque les espèces sont diversement sensibles à
l’infection.
·
Lors d’un reboisement, il ne faut surtout pas planter des
espèces sensibles à l’endroit ou ont été exploités des
sujets malades. Il faut utiliser de préférence des espèces résistantes.
·
Ne procéder à la nouvelle plantation qu’une fois le sol
désinfecté. Celui-ci doit être laissé au repos au minimum une
année après avoir déraciné les souches infectées. Remuer le
sol et y ajouter de la chaux quand cela est possible (2 à 5 Kgrs./m3).
b)
Mesures curatives :
Lorsqu’un
peuplement est attaqué, il est impératif de détecter le plus
rapidement possible les foyers d’infection de bien les délimiter.
·
Les arbres malades doivent être circonscrits par des fossés
de manière à les isoler des arbres sains par un fossé. La terre
provenant des fossés doit être rejetée à l’intérieur des
parcelles atteintes.
·
Il faut couper les arbres, les dessoucher, en prenant soin
d’enlever le maximum de racines.
·
Tout les produits de la coupe doivent être incinérés.
·
Une opération efficace, serait de rechercher les carpophores
et de les détruire dès leur apparition. Les basidiospores
assurent un mode de propagation.
·
Un certain nombre de produits chimiques ont une action
inhibitrice sur l’armillaire, on peut en asperger le sol.
Toutefois il est conseillé d’en user avec beaucoup de précautions;
C’est surtout le sulfure de carbone qui est préconisé car,
outre son action inhibitrice directe sur l’armillaire il
favorise la multiplication du trichoderma viride,
champignon qui a une action antagoniste sur l’armillaire.
Ces mesures ne sont
certes pas faciles à appliquer, et sont coûteuses, il faut au
moins veiller à une bonne sylviculture des peuplements
qui même si elle ne permet pas d’éradiquer le parasite freine
son attaque.
Méthode
d’échantillonnage:
Se placer à un
endroit où les symptômes de la maladie sont visibles et représentatifs.
Le sens de
progression du parcours est celui qui semble permettre la réalisation
la plus complète possible du parcours.
L’observation des
symptômes et dégâts est réalisé sur
tous les arbres sélectionnés dans chaque unité.
L’Agent de la
Protection des Forêts doit faire et prendre certaines précautions
lors des prélèvements du matériel infesté pour qu’ils
parviennent en bon état au laboratoire (notice: Prélèvement et
expédition des échantillons soumis à l’identification).Noter
les résultats (sévérité et % d’incidence)sur le
Rapport d’échantillonnage des Insectes et Maladies.
1.
la sévérité de la maladie est comme suite:
Nul
0
(% d’arbres atteints par la maladie ).
Trace 1
Léger 2 à 5
Moyen 6 à 25
Élevé
26 et plus.
2.
% d’incidence = Nombre
d’arbres atteints
X 100
Nombre d’arbres observés
·
Matériels
:
Carte, boussole,
podomètre, compteur de comptage, pour situé, dénombrer les
parcours et unités d’observation, et s’assurer des lieux ou
l’on passe et où l’on veut se rendre, un ruban de matière
plastique (ex.: rouge) est utile pour le marquage du point de
repère ou pour localisation du point de départ d’une virée. Couteau,
hache, sécateur, scie tronçonneuse,
écorçoir ces outils permet le prélèvement du matériel
sur l’arbre pour fin de détection, d’identification, d’évaluation
ou de vérification des dommages en cours. |
 revenir
au début revenir
au début
|
La maladie du charbon
de la mère
Hypoxylon
mediterraneum (De Not - Mill.)
|
|
|
|
Hypoxylon mediterraneum
(De Not.) Mill. (Ascomycète, Pyrénomycètes, Xylariale)
appelé « la maladie du charbon de la mère » est un
chancre qui se développe sur les arbres affaiblis des différentes
essences comme les chênes, les eucalyptus, les peupliers ect.
Hypoxylon
mediterraneum
est un parasite de blessure et de faiblesse qui prend un caractère
épidémique dès que des conditions défavorables surviennent
dans un peuplement (MALENCON
et MARION., 1951 In SAI, 1997); et il est apparemment peu
dangereux, et il ne doit en aucun cas être diffusé car ces
grandes facultés de conservation, sous forme saprophyte, et sa
dissémination aisée, sous forme parasite, en font un ennemi
potentiel non négligeable (LANIER, 1986a).
|
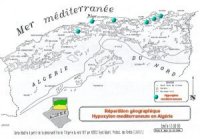
Répartition
géographique:
Hypoxylon
mediterraneum
est signalé sur l’eucalyptus au Portugal et le Maroc (LANIER, 1986a) et sur chêne liège en France,
Portugal et Italie et en subéraies d’Afrique du Nord (LANIER et
al., 1978). En Afrique, il a été signalé par, LANIER. (1986)
,et LIEUTIER et al. (1992).
Sa présence a été
constaté et confirmé par le laboratoire de pathologie I.N.R.F.)
sur chêne liège dans la forêt de Béni-Aïcha à
El-Ancer (Jijel), dans la forêt de Ouamchache (Chlef),
dans la forêt de l’Arbatache (Boumerdes), et dans la
forêt de Baïnem (Alger) ( SAI et CHAIBEDDRA, 1996).
|
 |
Dégâts:
·
Dessèchement de rameaux qui s’étant aux branches, puis
au tronc.
Jaunissement
du feuillage qui se dessèchent et tombent,
Par
défaut d’alimentation causé par le chancre l’arbre dépérit
progressivement (C.T.G.R.E.F.,
1980).
|
Biologie
:
|
Les ascospores
d’Hypoxylon mediterraneum , une fois libérées des asques
(voir schéma d’après SAI,
1997), vont germer sur du bois mort et constituent un foyer de
contamination et affectent des arbres par son pouvoir de pénétration
à la présence de blessures causées lors de l’élagage, de démasclages,
d’insectes etc.
Ces
ascospores donnent un mycélium indifférencié, champignon
de forme conidienne asexuée Botrytis sylvatia (TORRES,
1985).
|
|
Une
fois à l’intérieur du liber, le parasite a tendance à pénétrer
dans les vaisseaux et rayons libéro-ligneux, pour se défendre de
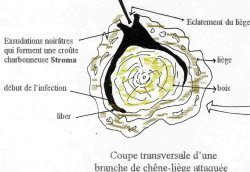
l’attaque, la zone malade secrète des exsudations sombres
filant des parties infestées. Le liber présente a ce stade des
zones irrégulièrement humidifiées allant d’une coloration rosâtre
à noirâtre ( symptômes initiaux de la maladie (SAI
et CHAIBEDDRA,
1996).L’exsudation
en séchant laisse un résidu partiellement goudronné, appelé le stroma
qui apparaît graduellement sous forme de plaques noires, dures et
charbonneuse dans les crevasse de l’écorce des parties malades
(TORRES,
1985).
|
 |
|
|
|
|
Il est à noter que
la progression de la maladie n’est pas irréversible. Quand la
croissance des chênes liège est vigoureuse, l’infection se
paralyse et passe inaperçue, jusqu’à ce que des facteurs défavorables
(ex: La sécheresse en général) accroissent la virulence du
parasite (SAI
et CHAIBEDDRA,
1996). Si au contraire ces facteurs disparaissent, et les chênes-lièges
recouvrent leurs vigueurs végétatives, leur prédisposition à
contracter la maladie diminue et des processus de cicatrisation
commencent à partir des zones saines du liber des arbres malades,
qui vont progressivement recouvrir les
parties mortes du liber
avec un nouveau tissus. (SAI et CHAIBEDDRA,
1996). |
 |
Symptômes
et éléments de diagnostic:
Lors
d’un dépérissement des arbres, tel que dessèchement de
rameaux, branches; ainsi que le jaunissement du feuillage, qui se
dessèchent et tombent, on doit chercher avec attention des
manifestations externes du parasite qui peut être à l’origine
de la maladie (MORELET,
1986a):
·
une
croûte charbonneuse sur rameaux, branches, et tronc, qui est sous
corticale, elle s’extériorise en provoquant l’éclatement du
liège indiquant ainsi la mort de l’arbre ou de la partie
atteint.
Méthode
de lutte et recommandation :
Le
seul moyen de lutte contre l’extension du champignon est le
recours aux traitements préventifs, aucun traitement curatif
n’existant maintenant. Une bonne sylviculture s’impose pour
maintenir le meilleur état sanitaire possible des peuplements (ABBAS, 1988, et KHOUS,
1990).
·
Une surveillance régulière des arbres doit être faite,
pour détecter la présence des plaques charbonneuses;
·
Il faut éliminer les parties atteintes (coupes
sanitaires);
·
Couper l’arbre au ras du sol s’il est complètement
atteint, il n’est pas nécessaire d’extraire le système
racinaire le champignon ne pouvant pas l’infecter;
·
Les produits de la coupe doivent être obligatoirement
incinérés, du fait qu’ils constituent des foyers de
contamination;
·
Il est conseillé de protéger les blessures ou plaies d’élagage
selon les moyens disponibles: badigeonnage au goudron de houille,
huile de lin. Ces blessures constituent des portes d’entrée
potentielles pour le parasite;
·
Lors du démasclage , il faut éviter d’arracher ou de
blesser le liber. Le liège doit être levé avec précaution après
s’être assuré qu’il va bien décoller (par sondage).Pour que
cette séparation se fasse facilement, le démasclage doit se
faire de préférence à l’époque ou l’assise
subiro-phellodermique est en pleine activité (montée de la sève).
L’entaille de décollement doit être limitée à l’épaisseur
du liège.(ABBAS & al., 1990; KHOUS, 1990; I.S.F., 1991; et
SAI & CHAIBEDDRA 1996).
|
 revenir
au début revenir
au début
|
|
|
Se
placer à un endroit où les symptômes de la maladie sont
visibles et représentatifs.
Le sens de
progression du parcours est celui qui semble permettre la réalisation
la plus complète possible du parcours.
L’observation des
symptômes et dégâts est réalisé sur
tous les arbres sélectionnés dans chaque unité.
L’Agent de la
Protection des Forêts doit faire et prendre certaines précautions
lors des prélèvements du matériel infesté pour qu’ils
parviennent en bon état au laboratoire (notice: Prélèvement et
expédition des échantillons soumis à l’identification). Noter
les résultats (sévérité et % d’incidence)sur le
Rapport d’échantillonnage
des Insectes et Maladies.
1
- La sévérité de la maladie est comme suite:
Nul
0
(% d’arbres atteints par la maladie ).
Trace 1
Léger 2 à 5
Moyen 6 à 25
Élevé
26 et plus
2
- Pourcentage ( %) d’incidence =
Nombre d’arbres atteints
X 100
Nombre d’arbres observés
Matériels
:
Carte, boussole,
podomètre, compteur de comptage, pour situé, dénombrer les
parcours et unités d’observation, et s’assurer des lieux ou
l’on passe et où l’on veut se rendre, un ruban de matière
plastique (ex.: rouge) est utile pour le marquage du point de
repère ou pour localisation du point de départ d’une virée. Couteau,
hache, sécateur, scie tronçonneuse,
écorçoir ces outils permet le prélèvement du matériel
sur l’arbre pour fin de détection, d’identification, d’évaluation
ou de vérification des dommages en cours. |
 revenir au début
revenir au début
|
La
fonte des semis est une des plus graves maladies en pépinières,
elle est responsable de la disparition rapide des jeunes
plantules en pépinières et parfois même en forêt.(GTGREF,
1980). Il s’agit d’une maladie cryptogamique causée par
des champignons microscopiques. Elle fait disparaître les
jeunes plantules dans des proportions parfois très élevées
(jusqu’à 70% à 80%) (PERRIN, 1986 In AZOUAOUI, 1996).
Elle touche la quasi-totalité des essences forestière élevées en pépinières.
Mais, elle affecte surtout les résineux. Les Cupressacées
comptent parmi les espèces les moins sensibles. En Algérie,
c’est nettement le pin d’Alep qui présente la
sensibilité la plus forte, suivi de près par le pin
maritime. Les feuilles sont en général moins sensibles
(AZOUAOUI, 1996).
|
|
Biologie
La
fonte des semis, qui se manifeste surtout lors des
printemps humides, est provoquée par divers
champignons microscopiques de la classe des Siphomycètes
et des Adelomycètes.
Les
agents de fonte vivent en saprophytes dans le sol et pénètrent
dans les tissus, tuent les cellules provoquant ainsi
le ralentissement ou la cessation des fonctions
essentielles de la plantule. Les organismes, au cycle
biologique varié, possèdent des formes de repos (sclérotes
ou chlamydospores) qui leur permettent de résister
assez longtemps à des conditions difficiles, de
persister dans le sol et d’assurer par la suite de
nouvelles infections (GTGREF, 1980).
|
|
Les
agents principaux de la fonte des semis sont les
genres Pythium spp., Fusarium spp. et Rhizoctonia.
Solani .Kühn
Remarque :
(GTGREF, 1980).
Le
développement de ces champignons est favorisé :
Par
un sol riche en matière azotée et de PH élevé (supérieur
à 5) qui fait obstacle au développement des
organismes antagonistes des agents d la fonte,
Par
une température moyenne douce (environ 20° C),
Par
un état hydrométrique élevé. |

Fonte
de semis( Photo CTGREF). |
|
|
Dégâts
et éléments de diagnostique
|
Dans un premier cas, un certain nombre de graines (cotylédons,
ridicule, tigelle), au moment de leur germination sont
contaminées dès les premiers stades(a). Elles sont
envahies par des micro-organismes pathogènes existant dans
la plupart des sols forestiers qui empêchent tout développement
de la plantule incapable de sortir du sol. Ce premier aspect
de fonte qui peut se chiffrer par la proportion de plantules
émergées par rapport au nombre de graines viables définit
de pré-émergence appelée encore « mauvaise levée ».
(GTGREF, 1980 & AZOUAOUI, 1996).
|
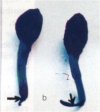
(a) (Photo
AZOUAOUI). |
|
Dans
un autre cas qui correspondant à la phase où La
fonte de semis se manifeste à partir de la
germination, au collet de la plantule (b) apparaît
une tache jaune-brunâtre qui noirci par la suite. A
ce niveau, les tissus altérés perdent leur
turgescence et leur rigidité, les semis se couchent
sur le sol, brunissent se dessèchent puis deviennent
difficilement visibles, La plante s’affaissent,
prend rapidement une teinte brune et fond, ils
« fondent », simultanément la maladie
progresse vers le bas et provoque la pourriture des
racines. C’est la fonte de post-émergence. Cet
aspect classique et fréquent, creusant des vides dans
les planches de semis correspond à la fonte de post-émergence.
(GTGREF, 1980 & AZOUAOUI, 1996). |

(b) (Photo
AZOUAOUI). |
Dans les cas les plus graves, les deux fontes combinées
peuvent amener le taux de plantules obtenu, par rapport au nombre de graines
susceptibles de germer à des taux de 3% (LANIER, 1962).
Les micro-organismes responsables de la fonte varient selon
les régions. Les substrats et les essences cultivées. La
variation au sein d’une même espèce végétale est peu
fréquente. (AZOUAOUI, 1996).
Les agents principaux de la fonte des semis sont les genres Pythium
spp., Fusarium spp. et Rhizoctonia. solani.
Ces agents pathogènes sont des champignons telluriques se
trouvant dans la plus parts des sols forestiers. Ils
deviennent parasites des tissus tendres des jeunes semis
qu’ils envahissent activement s’ils ne sont pas
combattus, et si toutes les conditions sont favorable
(AZOUAOUI, 1996).
Stratégie
de lutte
En
raison de la diversité des agents de fonte et des essences
cultivés, les moyens de lutte devront être adaptés cas
par cas et leur intensité sera en fonction de
l’importance des dégâts,
PERRIN (1985).
*
Précautions culturales :
-
Effectuer les semis sur des sols bien préparés, émiettés
à tendance acide par incorporation de tourbe, terre de bruyère
acide, sciure de bois (éviter les sciures à tanins :
chêne, avec rotation des semis, et litières forestières
soigneusement recueillies dans de vieux peuplement de
l’essence semée.
Cette
pratique, outre la constitution d’un milieu très
favorable à la levée, a l’intérêt d’apporter aux
jeunes semis les mycorhizes (champignons symbiotiques associés
aux racines) qui sont à la fois protectrices contre les
agents de fonte et favorables à la croissance. (AZOUAOUI,
1996).
-
Protéger les jeunes semis contre les excès de chaleur (ombrières)
et l’humidité (pas d’arrosage baignant).
-
Désinfecter soigneusement les outils de travail surtout
ceux utilisés dans les planche plus âgées, pour le désherbage
par exemple.
*
Les graines et le sol (s’ils sont infectés).
.-
Enrobage des graines :
En
fonction des résultats de l’analyse du sol faite au préalable,
on utilisera le PNCB (Quintozène) contre Rhizoctonia solani,
le prothiocarbe contre les Pythium, le bénomyl contre le
Fusarium.
-
la désinfection ménagée du sol:
avec
des fongicides à large spectre d’action tels que le
captane, le mancozèbe, le thirame, dithiocarbomate quelques
jours avant le semis, permettent de sauver une partie des
semis par des arrosages répétés, au besoin dans l’eau
d’aspersion ou l’aide de cocktails de fongicides visant
spécifiquement les espèces les plus redoutables.
-
La fumigation (bromure de méthyle, dazomet) sera retenue
dans le cas où se manifestent des risques importants ;
semis particulièrement précieux de graines rares, le
sols fortement contaminés les années précédentes.
-
l’analyse du sol avant culture
-
Une bonne précaution consiste à effectuer les semis
d’une année sur l’autre dans les endroits différents
de la pépinière (rotation des planches de semis), dont la
couche de surface devra être remplacée chaque année. |
|
|
|
 revenir
au début revenir
au début
ABBAS
M., 1988. Journée
d’étude sur le chêne-liège: Note sur , l’Hypoxylon mediterraneum
( De Not.) Mellea agent parasite du chêne-liège M.H.E.F., Département
Protection des Forêts Doc. interne protection des subéraies.
ABBAS
M., AICI M.,
& KHOUS M.G., 1989. Note sur la protection des subéraies. Journée
d’étude sur le chêne-liège. 6 pp.
ANSELMI
N., 1984. Rapport de
mission en pathologie forestière (Sept.-Oct. 1984 ), dans le cadre du
projet: P.N.U.D./ F.A.O. ALG./83/013.
AZOUAOUI
G., 1994 : Mycoflore associées aux semences de pin pinaster Ait :
impact phytopathologique. Les annales de la recherche forestière en Algérie.
1er semestre, p. 44-57.
C.T.G.R.E.F.
1980 Information Technique pour la Surveillance et la Protection
Phytosanitaire de la Forêt. 2è édition 1990. Centre Technique du Génie
Rural des Eaux et Forêts. Institut pour le Développement Forestier
-France.
CHAIBEDDRA
F. 1997
Problématique des dépérissement des forêts en Algérie. Conférence
journée d’étude CFATS - Jijel mai 1997. 10 pp.
D.S.F.
1990 Manuel du Correspondant - Observateur. Ministère de l’Agriculture
et de la Forêt - Direction de l’Espace Rural et de la forêt - Département
de la Santé des forêts
F.A.O./PNUD,
1986 Rapport final Phytosanitaire en Algérie, 1986.
GTGREF 1980., Fiches techniques des Insectes et Maladies des forêts. en
collaboration avec CEMAGREF
- division Protection de la Nature
France 4 pp.
GUILLAUMIN
J.J., 1985. .
Contribution à l’étude des
armillaires phytopathogènes, en particulier du groupe Mellea: cycle
carylogique, notion d’espèce, rôle biologique des espèces. Thèse
Doct. Univers. Claude-Bernard. Lyon - France.
GUILLAUMIN
J.J., BERNARD Ch., DELATOUR C., & BELGRAND M.,
1984. Contribution à l’étude du dépérissement du chêne,
pathologie racinaire en forêt de Tronçais 21 pp.
I.S.F.
(Information Santé
des Forêts n°7), 1991 : Le dépérissement du chêne-liège
( Quercus suber). Ministère de l’Agriculture et de la Forêt -
France. Département de la santé des forêts. Janvier 1991.
KHOUS
M.G.,
1990. Réalités sur
l’état sanitaire des subéraies Algériennes: Facteurs de dégradations
et mesures impératives à prendre. Séminaire sur la Protection des
Suberaies Jijel, 1990.
KHOUS
M.G., AICI M., & ABBAS M.,
1988. Rapport de mission dans la wilaya de Jijel : dépérissement
du chêne-liège. I.N.R.F. 3 pp.
LANIER
L., 1986 La fonte des semis Notes techniques forestières n° 14 7p.
LANIER
L., 1986a. Rapport
intérimaire de mission en pathologie forestière dans le cadre du
projet: P.N.U.D./ F.A.O. ALG./83/013.
LANIER
L., 1986b. Deuxième
rapport intérimaire de mission en pathologie forestière dans le cadre
du projet: P.N.U.D./ F.A.O. ALG./83/013.
LANIER
L., JOLY P., BONDOUX P., & BELLEMERE, 1978.
Mycologie et pathologie
forestière. Tome
I. 461 pp. Ed. Masson.
1978.
LIEUTIER
F., VOULAND G., & KHOUS M.M.,
1992. Rapport de mission sur les dépérissements forestiers en Algérie
et rôle des insectes xylophages dans le cadre du projet de coopération
INRA France/ INRF - Algérie. Projet 89/HYDR/12 et, MAE/2939B.
MORRELET
M.,
1986a. Le diagnostic des
maladies fongiques en forêt. RFF XXXVIII n° spécial .
MORRELET
M.,
1986b. Pathologie
contamination forestière. Rapport de mission en pathologie forestière
(nov. - Déc., 1986 ), dans le cadre du projet: P.N.U.D./ F.A.O. ALG./83/013.
MOTTA
E., 1986 Les champignons pathogènes sur graines forestières. Bull.
OEPP. 16. p.565-569.
PERRIN
R., 1985 Compte rendu de mission en Algérie INRA. Paris 8 p. Projet
FAO-PNUD. ALG.83/103.
PIGNON
J., 1986 La sélection
pour la résistance aux maladies. RFF. XXXVIII n° spécial pp.:
228-233.
SAI
K. & CHAIBEDDRA F. 1996
Rapport préliminaire sur le dépérissement du chêne-liège ( Quercus
suber ) dans la wilaya de Jijel. Doc. interne, 7 pp.
SAI
K., 1997 Présence
de deux champignon parasites de nos forêts: l’Armillaria mellea
( Vahl. ) Quèl. et, Hypoxylon mediterraneum ( De Not.)
Mill. Conférence journée d’étude CFATS - Jijel mai 1997. 13 pp.
TORRES
J., 1985
El-Hypoxylon mediterraneum ( De Not.) Mill. y su compartamiento en las
encineras andaluces. Bol.
Serv. Plagas (2) pp.: 185-191.
ZERAIA
L., 1971 Le chêne-liège:
La récolte du liège, CNREF INRA d’Algérie 28 pp.
 revenir
au début revenir
au début
|

