| La processionnaire du cèdre | Vues 9664 fois |
|
La processionnaire du cèdre Thaumetopoea bonjeani POWEL.
|
|
|
|
émail: gachi_mustapha@yahoo.fr
Les forêts algériennes et notamment les cédraies naturelles sont soumises à une forte pression anthtropique (surpâturage, coupe de bois et parfois incendies) et à des conditions climatiques sévères avec des phases de sécheresse prolongée influant négativement sur la croissance des arbres et la régénération naturelle. Concernant les cédraies naturelles et principalement celles des Aurès (Atlas saharien), les peuplements occupent la latitude la plus méridionale et se trouvent dans les étages sub-humide et semi-aride avec une pluviométrie annuelle de 400 à 500mm. En outre, nous assistons depuis le début des années 1980 à des dépérissements de cèdres au Bélezma et à Théniet El Had (Ouarsenis) qui se traduisent par le dessèchement de ces arbres qui restent localisés sous forme de petits foyers en bouquets de cinq à six arbres. Ces dépérissements inquiétants restent inexpliqués malgré les recherches qui ont été menées et qui avaient pour but d'identifier les facteurs inducteurs de ces dépérissements. A côté de ceci, une forte pullulation d'un insecte jusque là inconnu en Algérie est signalée au Bélezma en 1982 par la Conservation des Forêts de Batna. Il s'agissait de la processionnaire d'été Thaumetopoea bonjeani (qui n'était connue que du Maroc) dont l'intensité de l'attaque a été surprenante. En effet, près de 500 hectares de cèdres ont été touchés par ces attaques. Des défoliations atteignant parfois les 100% ont été enregistrées donnant aux arbres un aspect d'arbres calcinés. Il est certain que le recouvrement en altitude sur le pourtour méditerranéen, des aires de répartition des processionnaires d'hiver avec celles des processionnaires d'été a fait que les deux groupes ont été régulièrement confondus entre eux. Cela a été le cas au Maroc en 1922 où les attaques de T. pityocampa ont été durant des années, attribuées à T. bonjeani espèce qui fût de ce fait considérée à tort comme la seule processionnaire pouvant vivre sur cèdre (DEMOLIN, 1987).
|
|
Position systématique Ordre: Lepidoptera Famille: Thaumetopoeidae Genre: Thaumetopoea Espèce: bonjeani Auteur: POWEL.
La famille des Thaumetopoeidae a été classée à cette catégorie taxonomique en 1900 et possède un (01) seul genre, Thaumetopoea, auquel on connaît les 9 espèces suivantes (AGENJO, 1941): solitaria (FREYER), processionea (LINNAEI),pityocampa (SCHIFFERMULLER), wilkinsoni (TAMS), pinivora (TREITSCHKE), bonjeani (POWELL), herculeana (RAMBUR), jordana (STAUDINGER) et cheela (MOORE). Les huit (8) premières vivent dans la région paléarctique ; cheela habite en Inde (DEMOLIN, 1987 & GACHI, 1989). |
|
C’est au Maroc que la processionnaire du cèdre a été décrite pour la première fois sous le nom de Cnethocampa bonjeani Powel à partir d’insectes originaires du Moyen Atlas (POWELL, 1922). Elle a par la suite été reclassée dans le genre Thaumetopoea (Traumatocampa) par AJENGO lors de sa révision des Thaumetopoeidae (AJENGO, 1941). Son appartenance à ce genre fut ensuite conservée par KIRIAKOFF (KIRIAKOKK, 1970 in DEMOLIN, 1987).
Périodes et facteurs de séparation des différentes espèces
Processionnaires d’été
Il semblerait que durant la période des glaciations, les processionnaires d’été, par leurs exigences climatiques très septentrionales pouvaient se développer sur une aire très étendue couvrant tout le bassin méditerranéen. Lors du recul des glaciations, ces espèces se sont repliées pour survivre, soit vers le nord de l’Europe, soit en altitude dans le partie méridionale de leur aire de répartition. Ce qui explique leur présence :
1. au niveau de la mer, au bord de la Baltique, 2. à moyenne altitude en France, en Italie et en Espagne, 3. à très haute altitude, dans les pays du Maghreb et au Liban.
Ces mouvements très importants qui aboutissent obligatoirement à des isolements génétiques de plus ou moins longue durée, particulièrement dans les zones d’altitude, ont provoqué l’apparition de nouvelles variétés très différenciées (voire même de nouvelles espèces).
Processionnaires d’hiver
Dans le cas des deux processionnaires d’hiver T. pityocampa et T. wilkinsoni, il est établi qu’elles ont :
- les mêmes exigences climatiques, - le même complexe parasitaire, - la même phéromone sexuelle, - la possibilité au laboratoire de se croiser entre elles avec l’obtention d’hybrides viables.
Ces constats bioécologiques prouvent à posteriori qu’il s’agit certainement d’une seule et unique espèce. L’hypothèse la plus vraisemblable est que la processionnaire d’hiver aurait eu une aire de répartition très vaste en périodes non glaciaires. Au moment de l’avancé d’une des glaciations, l’aire de répartition se serait scindé, vers le sud, en deux parties, l’une située au sud-est du bassin méditerranéen et la seconde située en Afrique du nord. Lors du recul de la glaciation, l’aire de répartition se serait à nouveau étendue à partir de ces deux foyers de repli. La reconquête s’effectuant alors vers l’Europe à partir de l’Afrique et, vers la Turquie, à partir du Moyen-Orient. La "vague de l’Ouest" était devenue pityocampa, la "vague de l’Est" wilkinsoni. Par la suite, DEMOLIN (1987) indique que les processionnaires d’été vivant sur résineux ont un développement qui se rapproche de celui de la processionnaire du chêne vivant sur feuillus. En effet, ces deux espèces présentent un arrêt de développement hivernal de l’embryon complètement formé dans l’œuf qui n’éclore qu’au moment du débourrement de la plante hôte. Cette coïncidence phénologique temporelle avec le végétal hôte peut s’expliquer pour un insecte vivant sur feuillu mais s’explique difficilement pour un insecte vivant sur résineux, végétal qui assure du feuillage nutritif sur toute l’année. Ceci laisse supposer que la filiation la plus vraisemblable pour ces espèces serait : processionnaire du chêne, processionnaires d’été vivant sur résineux, puis processionnaires d’hiver vivant également sur résineux. |
|
Répartition géographique L’espèce a été signalée pour la première fois dans les cédraies de haute altitude à AZROU (moyen Atlas) au Maroc en 1921 (AGENJO, 1941). En Algérie (cf. carte de répartition de l’insecte), l’insecte a été découvert en 1982 dans la cédraie du Bélezma. Depuis, sa présence a été confirmée à la suite d’investigations dans les cédraies suivantes (GACHI et al., 1986; & GACHI, 1989): |
|
|
Son aire potentielle correspond à l'aire de répartition des cédraies. La dispersion spatiale à l'intérieur de la masse forestière est assurée par les adultes femelles qui restent malgré leur état gravide de bons voiliers. L'infestation se réalise d'abord en lisière, au niveau des arbres isolés, en bordure de clairières ou de pistes puis en cas de fortes attaques pénètre alors plus profondément à l'intérieur de la masse forestière. (GACHI et al., 1986).
|
|
DONNEES GENERALES SUR LE CEDRE DE L'ATLAS (Cedrus atlantica MANETTI) |
|
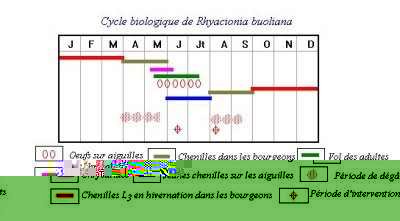
Cycle Biologique:
|
|
Caractéristiques biologiques
T. bonjeani présente certaines caractéristiques qui la différencient de la processionnaire du pin T. pityocampa connue en Algérie comme étant le principal ravageur des pins et du cèdre. En effet, la processionnaire du cèdre présente une diapause au stade œuf et un développement larvaire printano-estival. A l’inverse de la processionnaire du pin, T. bonjeani ne tisse pas de nid structuré ; elle vit regroupée en colonie sous forme de pelote avec un très léger tissage. Notre identification de l’insecte a été basée sur ces descriptions ainsi que sur la morphologie du canthus, de la patte antérieure du mâle ainsi que sur l’étude des génitalia La ponte est chez la processionnaire du cèdre est la phase que l’on retrouve le plus longtemps sur le terrain (plus de huit mois). Aussi, nous lui avons consacré presque la totalité du chapitre. La processionnaire du cèdre accompli son cycle en 5 stades larvaires. Son développement printano-estival lui permet de ne pas tisser de nid comme il est de coutume chez Thaumetopoea pityocampa. Les colonies vivent groupées en pelotes avec un très léger tissage de soie (QUESTIENNE et al., 1978; & GACHI et al., 1986). |
|
|
||
|
|
||
|
||
|
La femelle dépose ses oeufs en progressant vers la base du rameau. Les écailles sont déposées comme les tuiles d’un toit. Les rameaux choisir par la femelle sont flexibles pendant vers le bas de l’arbre, les écailles se trouvent orientées vers le sol, ce qui assure la protection de la ponte par un ruissellement vers le bas des eaux de pluie. les écailles de T. bonjeani sont petites et pointues, ce qui les différencie aisément des écailles des femelles de T. pityocampa SCHIFF. qui vit sur cèdre. FRITAH (1984) sépare les deux espèces sur la base de la forme et de la taille des écailles de la touffe anale des femelles. Les écailles recouvrant les pontes confèrent à celles-ci une couleur grise très proche de celle de l’écorce de cèdre. cette homochromie rend ainsi les pontes très difficiles à déceler. Les écailles de Thaumetopoea bonjeani sont petites et pointues, ce qui les différencie aisément des écailles de la femelle de Thaumetopoea pityocampa qui vit sur cèdre (GACHI, 1989). Nous pensons que les branches basses sont choisies préférentiellement par les femelles gravides à cause de leur poids important qui les empêche de voler à forte hauteur et de la situation chez les arbres âgés des premières branches qui naissent à 1m ou 1, 5m du sol(GACHI, 1989).. La longueur des pontes de Thaumetopoea bonjeani est de 3, 22 cm en moyenne (1,2 cm - 5,45 cm). Les oeufs sont déposés en rangées en nombre variable (4 à 6). L’œuf présente une forme arrondie. La face supérieure est bombée et la face inférieure plate. Ceci augmente la surface de contact de l’œuf collé au rameau, l’œuf s’en trouve donc solidement ancré à son support. Il est de couleur blanche et ses dimensions sont de 0,9 à 1 mm de long sur 0,7 à 0,75 mm de large. Pour voir les différentes photos de l'insectes cliquer ici
Durée moyenne d’incubation:T. bonjeani développe un arrêt de développement au stade œuf après la formation de la jeune chenille, les températures journalières cumulées couvrent une période s’étalant de août à avril, soit près de 8 mois.
La diapause embryonnaire: L’embryogenèse débute immédiatement après la ponte. Une fois les chenilles complètement formées (près de deux mois après), elles présentent une diapause qui leur "interdit" de sortir du chorion. La diapause s’achève au début du mois de février, elle est alors prise en relais par un développement de post-diapause dont la durée est dépendante de la température. Selon EL YOUSFI (1987), le minimum demandé pour l’éclosion (durée de la diapause obligatoire) est de trois mois. Les éclosions ont lieu à la fin Avril ou au début du mois de Mai, selon les conditions climatiques, assurant une coïncidence temporelle avec le débourrement des cèdre (QUESTIENNE et al., 1978; & GACHI, 1989).
Observation des éclosions:La levée de l’arrêt de développement de la jeune chenille est déterminée par les températures. GIESE et CASAGRANDE (1981) reconnaissent l’importance d’unités thermiques, les degrés/jour dans la prédiction de l’éclosion des œufs de L. dispar. |
||
|
Les larves durant leur cycle évolutif subissent quatre mues successives. Les chenilles de Thaumetopoea bonjeani se distingue aisément de Thaumetopoea pityocampa par la coloration des chenilles, par la faible activité de tissage des larves âgées (en général absence de bourses bien architecturées) (QUESTIENNE et al., 1978). A la fin du mois de Juin, les Chenilles du stade L5 quittent les arbres en procession pour aller s’enfouir sous terre (QUESTIENNE et al., 1978; & GACHI et al., 1986).
|
|
Stades larvaires et processions de nymphose: Pour voir les différentes photos de l'insectes cliquer ici
Premier stade larvaire (L1):Les chenilles du premier stade apparaissent vers la fin de la première semaine du mois d'Avril. L'ornementation des chenilles est remarquable par la longueur des soies blanches disposées sur les plaques latérales. Les jeunes chenilles recouvrent la ponte d'un léger tissage qui favorise le maintien de la cohésion de la colonie. Dès leur éclosion, les jeunes chenilles qui se sont rassemblées sur la ponte, se regroupent en plaque et se frottent latéralement les unes contre les autres. Très rapidement, un ou deux chefs de file vont sortir du groupe et être suivis par les autres individus de la colonie. La procession se constitue ainsi progressivement. Deuxième stade larvaire (L2): A partir du deuxième stade larvaire, les chenilles sont marquées par une augmentation progressive du nombre de soies ornementales blanches. Les chenilles du 2ème stade se caractérisent par la présence de longues soies blanches sur toutes les plaques latérales de tous les segments.
Troisième stade larvaire (L3):On note l'apparition, dérivant des trapézoïdaux dorsaux postérieurs, du dispositif de petites plages urticantes sur les quatre segments abdominaux 1, 2, 7 et 8. Quatrième stade larvaire (L4): Les trapézoïdaux dorsaux antérieurs de l'abdomen sont devenus très proéminents, ils sont de couleur rose-violacé. Les miroirs urticants sont à 4 plages.
Cinquième et ultime stade larvaire (L5): Les chenilles du cinquième et dernier stade vivent regroupées en pelote et sans nid (à l'inverse des chenilles de la processionnaire du pin qui en tissent), les colonies sont donc peu visibles sur les rameaux feuillus des grands cèdres. A ce stade, la chenille attaque seule l'extrémité de l'aiguille avec ses mandibules puissantes et la dévore en entier. Les dispositifs de défense bourrés de poils urticants noir violacé visibles du fait de l'absence pratiquement totale, en position dorsale, des longues soies d'ornementation. Contrairement à ce qui est mentionné par AJENGO en 1941, T. bonjeani ne tisse jamais de nids, se déplace fréquemment et n'effectue qu'un léger tissage à l'emplacement des lieux de mue. Pour voir les différentes photos de l'insectes cliquer ici
Processions de nymphose: Les processions de nymphose, observées du début de la quatrième semaine du mois de Juin à la fin de la deuxième semaine du mois de Juillet, ont lieu très tôt le matin et se poursuivent jusqu'à ce que la température atteigne au sol 20°C. Elles reprennent en fin d'après midi lorsque les températures retombent. Le comportement à ce stade est très semblable à celui de T. pityocampa (regroupement, départ et enfouissement). Trois jours après les enfouissements, les chenilles ont toutes tissé leurs cocons; les chrysalides quant à elles sont formées 7 à 8 jours après. La durée de la diapause embryonnaire au Belezma est donc de huit mois et demi.
Diapause nymphale: Diapause estivale: Le cycle de Thaumetopoea bonjeani comporte régulièrement une diapause nymphale estivale. La morphogenèse des adultes débute pour l'ensemble de la population de la fin Juillet à la mi-Août, c'est à dire un mois à un mois et demi d'arrêt de développement. Cette période a été déterminée à partir d'observations sur le terrain de 300 chrysalides femelles qui renferment un adulte en voie de développement où l'on voit par transparence la disparition progressive des lobules de graisse de réserve sous-cuticulaires. Cette disparition est tout au début de l'évolution, particulièrement nette à la hauteur du dernier segment abdominal des femelles, dans la zone de formation des écailles protectrices des oeufs (DEMOLIN 1987). En basse cédraie, Thaumetopoea bonjeani P. développe en versant Nord une diapause de 12,17% de type N+1, alors qu'en versant Sud, aucun individu n'a marqué de diapause prolongée. En haute cédraie, nous avons relevé deux types de diapause: une diapause d'une année en forte proportion (53%) et, près de 12% de type N+2 en versant Nord. En versant Sud par contre, environ 18% des populations restent en diapause d'un an.
Diapause prolongée: Une période complémentaire de diapause prolongée d'un an ou plus peut faire suite à la diapause estivale. En effet, toutes les chrysalides de l'année N ne donnent pas obligatoirement des adultes la même année. La population imaginale pourra en un pourcentage variable se répartir sur l'année, N, N+1, voir l'année N+2. Des échantillonnages sur de nombreuses populations naturelles nous ont permis de constater que le taux de diapause prolongée variait considérablement d'année en année et d'une localité à l'autre.
Variations de la diapause: La chenille processionnaire du cèdre subit des conditions climatiques quelque peu variées à l'intérieur de son aire de répartition. L'influence de la température dans le déclenchement ou non de la diapause prolongée a été étudiée au niveau de deux stations d'altitude différente. A l'intérieur de chaque station, nous avons choisi deux expositions contrastées pour mieux préciser l'effet thermique.
Sortie de terre: Il semblerait donc que les sorties sont lieu en même temps pour les mâles et les femelles. A contrario, chez la processionnaire du pin, on enregistre une protandrie, les mâles sortant toujours une demi heure avant les femelles (DEMOLIN, 1969 et ZAMOUM, 1998). Les adultes de T. bonjeani volent en Août-septembre (AJENGO, 1941). En effet, les émergences des papillons débutent dès la fin de la première semaine du mois d'Août pour cesser vers la mi-Septembre (GACHI et al., 1986).
Comportement envol des adultes et sex-ratio: Trois années de suite (de 1986 à 1988), des captures horaires au piège lumineux ont été réalisées au Belezma par GACHI (1989). Ceci nous a permis de comprendre quelques aspects du comportement des adultes qui est entièrement crépusculaire à nocturne. Il est en apparence très semblable à celui observé chez la processionnaire du pin, particulièrement en ce qui concerne les séquences de formation du dispositif alaire (DEMOLIN, 1987). Il s'en différencie par contre par une phase d'appel des femelles beaucoup plus tardive. C'est généralement la nuit qui suit celle de l'émergence que les femelles sont très attractives. Une heure environ après la tombée de la nuit, soit à 21 heures (heure locale), les femelles dévaginent leurs glandes génitales et émettent la phéromone sexuelle, invitant ainsi les mâles à l'accouplement. Vers minuit, plus aucun accouplement n'est observé et la dissection des femelles capturées à partir de cette heure montre que celles-ci sont fécondées. De 22 heures au lever du jour, les femelles déposent leurs oeufs. Les émergences des imagos débutent à la fin de la première semaine du mois d'Août et se poursuivent jusqu'au début de la deuxième semaine de Septembre. Les 50% des émergences ont été obtenus en 1988, soit le 21 Août. Les résultats des captures au piège lumineux durant les années 1986 à 1988 (voir tableau ci-dessous) traduisent unes régression continue des populations de Thaumetopoea bonjeani au Belezma. Par contre, il y a une remontée du sex-ratio, ce qui dénote un retour progressif à l'équilibre des populations à un faible niveau. Variations des captures annuelles des adultes de Thaumetopoea bonjeani et du sex-ratio:
* Source GACHI, 1989.
Déploiement des ailes: Cette étape dure de 30 à 45 minutes (DEMOLIN, 1987) et s'effectue en trois phases : * développement des ailes par pulsion hémolymphatique dans les nervures, * redressement en position verticale, séchage, * rabaissement en position de repos. A la tombée de la nuit, l'adulte (mâle ou femelle) rejette son méconium (liquide marron constitué de déchets résultant de la morphogenèse et qui sont stockés dans une poche spéciale appelée poche à méconium) et s'envole.
Appel du mâle: A la tombée de la nuit, les femelles âgées de 24h00' dévaginent leurs glandes odoriférantes (Planche 11, Photo 3) faisant libérer ainsi la phéromone sexuelle, invitant les mâles à l'accouplement. La femelle en appel se présente agrippée sur son support par ses quatre pattes (antérieures et médianes), le corps arqué vers l'arrière, les antennes reposant le long du corps en position de toit.
Accouplement: Le mâle, attiré par la phéromone émise par la femelle, , se présente tout agité, les papilles rectales frémissantes, arrivant même à bousculer sa partenaire autour de laquelle il tournoie avant de s'arrêter auprès d'elle. Il s'y accouple alors très vite et l'accouplement dure 45 minutes à 1 heure. Une fois l'accouplement terminé, les deux partenaires se quittent et s'envolent.
Étude de la phéromone sexuelle:
En 1987, il a été procédé à l’analyse chimique de la phéromone sexuelle de T. bonjeani à partir d’adultes femelles émergées de chrysalides conditionnées au niveau du Col Telmet. Pour T. pityocampa (DEMOLIN, 1988) et T. wilkinsoni Tams (FREROT, 1990), leurs femelles commencent à appeler quatre heures après leur émergence, la production de la phéromone étant maximale dès la première nuit. Dans le cas de T. bonjeani, la glande excisée quatre heures après l’émergence des femelles démontre après analyse l’absence de la phéromone sexuelle dans l’extrait. Depuis, n’étant attractives que la seconde nuit après l’émergence, les glandes sexuelles ne sont excisées qu’à partir de ce moment-là à l’aide de très fins ciseaux. En effet, selon FRÉROT et al. (1990), les glandes excisées quatre heures après l’émergence des femelles révèlent après analyse l’absence de phéromone dans l’extrait. |
||||||||||||
|
Pertes de croissance radiale: Des études ont été réalisés par GACHI sur les accroissements radiaux qui sont cumulés pour chaque parcelle durant toute la période des dégâts (1982 à 1986). La différence de croissance entre les parcelles 1, 2, 3 et leurs parcelles témoins respectivement sera cette perte de croissance effective causée par les défeuillaisons de Thaumetopoea bonjeani. Étant donné l'insuffisance des renseignements que nous possédons sur la gradation de 1982, nous nous sommes limités aux pertes des seules parcelles étudiées. Nous trouvons ainsi une perte de croissance moyenne pour les trois parcelles pendant la durée des effets des défoliations de Thaumetopoea bonjeani de l'ordre de 56%. La perte de croissance enregistrée sur le cèdre pendant 5 ans est en moyenne de 2,93 mm. Nous pensons que l'intensité moyenne de défeuillaison des arbres qui ont servi à nos mesures a été nettement inférieure à sa valeur estimée. Cependant, elle aurait dépassée les 50 % puisque selon DU MERLE et GERAUD 1988 (In GACHI, 1989 ), des défoliations de l'ordre de 50% provoquées par la Tordeuse du sapin Choristoneura murinana. |
||||||||||||
|
Complexe parasitaire de Thaumetopoea bonjeani Pour voir les différentes photos de l'insectes cliquer ici Nous n'évoquons ici que les facteurs constituant le Complexe parasitaire de Thaumetopoea bonjeani (Parc de Belezma- Algérie), rattaché aux différentes phases de développement de Thaumetopoea bonjeani (GACHI, 1989): a/ Parasitoïdes des oeufs: - Ooencyrtus Ooencyrtus. - Trichogramma. A partir des pontes prélevées depuis 1986 au Belezma, deux parasitoïdes ont été découverts, il s'agit d'Ooencyrtus et Trichogramma. L'Ooencyrtus a été déterminé par GRAHAM comme étant O. pityocampae. Cet Encyrtide était considéré jusqu'alors comme spécifique à Thaumetopoea pityocampa. L'évolution d'O. Ooencyrtus se produit en cinq stades larvaires qui durent 1 jour environ. La larve de 5ème stade, parvenue à maturité, pourra soit se nymphoser pour donner un adulte: il s'agit de la première vague d'émergence qui a lieu en Septembre, soit rester en diapause à l'intérieur de l’œuf hôte jusqu'en Juin-juillet de l'année qui suit pour donner une seconde vague. L'action de ce parasitoïde est très importante: sur 200 pontes elle a été estimée à 38,4% . Le Trichogramme quant à lui n'a pas pu être déterminé avec précision, il ressemble beaucoup à celui trouvé sur la processionnaire du pin (DEMOLIN ,1987). Il est très faiblement présent et ne touche que 0.64% de la population au stades oeuf. b/ Parasitoïdes des stades chenilles et chrysalides: - Exorista segregata Rond.( Tachinaires). - Compsilura concinata Meig ( Tachinaires). - Aspergillus sp. (champignon parasite ). Deux diptères Tachinaires polyphages ont été recensés: Exorista segregata Rond. et Compsilura concinata Meig. Ces deux parasitoïdes réunis n'ont qu'une activité limitée sur le dernier stade larvaire de Thaumetopoea bonjeani soit, 1.4% . Un champignon parasite a également été trouvé sur chenilles enfouies et sur chrysalides. Il a été déterminé par le Centre de Recherches Bio systématiques du Canada comme étant Aspergillus sp. Son action est très faible, elle est de l'ordre de 0.7% . |
||||||||||||
|
CONCLUSION GÉNÉRALE La processionnaire du cèdre est présente dans toutes les cédraies d’Algérie. Cette espèce est entourée d’un cortège d’ennemis naturels dont cinq ont pu déjà être recensés et pour deux d’entre eux étudiés. Ces parasites appartiennent, pour la plupart, aux complexes parasitaires de deux autres ravageurs importants des forêts : T. pityocampa dont les populations sont présentes dans la cédraie ou se développent à proximité et Lymantria dispar qui prolifère souvent dans les chênaies jouxtant les cédraies. Ils pourraient probablement appartenir au cortège de parasites d’Ephesia nymphaea (Lep., Catocalinae) qu’on ne connaît pas mais, dont les populations étaient en forte densité durant les années 1987 à 1991. De l’avis de DEMOLIN (1987), T. bonjeani a un intérêt scientifique international, non seulement pour les fondamentalistes qui s’intéressent aux Thaumetopoeidae mais surtout parce que cet insecte représente un des ravageurs parmi les plus importants pour toutes les cédraies d’altitude déjà considérées comme d’une fragilité extrême. Il concerne au premier plan l’Algérie, le Maroc, la Turquie et le Liban, mais aussi tous les pays européens qui souhaiteraient introduire le cèdre à relativement haute altitude et en plantation monospécifique. La découverte, avec une forte probabilité de certitude de la phéromone sexuelle, constituée d’un mélange de deux composés ; le (Z,Z)-11,13-héxadécadiénal (80%) avec le (Z,Z)-11,13-hexadécadiénol (20%), a une importance biologique fondamentale car elle permettrait ultérieurement, en comparaison avec d’autres extraits glandulaires de différentes espèces de processionnaires d’été, de pratiquer une approche systématique plus précise. Elle a aussi une importance pratique comme celle de préciser l’aire exacte de répartition de l’insecte, et d’envisager à terme de nouvelles stratégies de lutte avec utilisation de la phéromone. En ce qui concerne les risques d’infestations graves en Algérie, notre avis rejoint celui de DEMOLIN (1987) qui stipule que ces risques sont faibles mais non nuls ; d'autant plus que qu’en 2001, une infestation a été signalée au mont Chélia, au lieu-dit Ras Keltoum par la Conservation des forêts de Khenchela. Cette infestation a touché 10 hectares en 2001 et plus de 100 hectares en 2002. On est amené à penser que l'on est en face du début d'une forte pullulation. Ce qui implique la mise en place d’un réseau de surveillance structurée dans le cadre du réseau national de protection phytosanitaire. En ce qui concerne la lutte contre ce ravageur, elle doit être envisagée avec précaution : - au printemps avec des insecticides biologiques à base de Bacillus thuringiensis si la seule processionnaire du cèdre est concernée. - en hiver avec des insecticides d’ingestion à forte rémanence (en ULV en suspension avec le gasoil) si les deux processionnaires sont concernées. Ce traitement curatif en hiver contre T. pityocampa serait également préventif au printemps contre T. bonjeani. Cette méthode aurait pour avantage de respecter l’entomofaune globale des cédraies en ne touchant que les insectes qui se nourrissent sur cèdre au printemps tout en épargnant ceux vivant sur feuillus et autres végétaux à feuilles caduques. De par le fait que c’est la première gradation de l’espèce qui a conduit à sa découverte, les mécanismes de régulation des populations de ce ravageur n’ont pas été cernés. Dans cette étude, nous n’avons pas dressé de table de mortalité ; en effet, au même titre que la processionnaire du pin (ZAMOUM, 1998), les mêmes difficultés se posent quant à l’utilisation des tables de mortalité, du fait du comportement grégaire de l’insecte, de la recomposition permanente de ses effectifs et de ses migrations depuis des sites d’alimentation vers des sites diversifiés de nymphose dans le sol. Toutefois l’étude de la biologie et du comportement du ravageur a permis de recenser quelques facteurs principalement d’ordre biotique intervenant dans la limitation des effectifs de l’espèce qui mériterait d’être entreprise en détail sur les différents stades de développement et sur des effectifs beaucoup plus importants. |
||||||||||||
|
AGENJO R., 1941. Monographia de la familia Thaumetopoeidae ( Lepidoptera, thaumetopoeidae ). Eos, Rev. Esp. Ent. XVII. pp.: 69-130. BALACHOWSKI S.A., 1951. La lutte contre les Insectes. Principes - Méthodes - Applications. Payot. Paris. 380 p. DEMOLIN G., 1969. Bioécologie de la procesionaria del pino Thaumetopoea pityocampa SCHIFF. Incidencia de los factores climaticos. Bol. Serv. Plagas For. 12 n° 23 pp.: 9-22. DEMOLIN G. 1987. Rapport scientifique et iconographique de la processionnaire du cèdre: Thaumetopoea bonjeani POWEL. FAO/PNUD Projet n°DP-FO-ALG./83/013 EL YOUSFI M. 1987 Thaumetopoea bonjeani ( POWEL. ): La Processionnaire du cèdre. Polycopié Min. Agr. Ref. Agr. 14 p. + 7 pl. FREROT B. et al. 1988. Chemical analysis of the sex pheromone glands of Thaumetopoea bonjeani (POWEL). Experientia. 5 p. GACHI M. et al., 1986. Note sur la présence en Algérie de la processionnaire du cèdre Thaumetopoea bonjeani POWEL. ( Lepidoptera, Thaumetopoeidae ) Ann. Rech. Forest. en Algérie. n°1 pp.: 53-63. GACHI M. 1989. Eco-biologie de la processionnaire du cèdre Thaumetopoea bonjeani POWEL. ( Lepidoptera, Thaumetopoeidae ) en Algérie. Séminaire International de Biologie - Constantine. Mai 1989, 13 p. GACHI M. 1998 La Processionnaire du cèdre ( Thaumetopoea bonjeani POWEL. ). Journée d’étude en entomologie et pathologie forestière. INRF. Mai 1998. pp.:25 -32. GACHI M. 2004 Contribution l’étude de l’éco-biologie de la processionnaire d’été Thaumetopoea bonjeani P. (Lep. Thaumetopoeidae) dans la cédraie du Bélezma Aurès thèse de Magister USTHB Alger. QUESTIENNE P.; et MIERMONT Y., 1978. Contribution à la connaissance de Thaumetopoea pityocampa SCHIFF. Étude de la chenille processionnaire du pin et du cèdre au Maroc. Ann. Rev. For. Maroc, Mai 1978. pp.: 153 et 156. BILIOTTI E., 1958 Les parasites et prédateurs de Thaumetopoea pityocampa Schiff. ( Lepidoptera). Entomophaga, Tome III, n° 1 pp.: 23-34. BILIOTTI E., 1970 Perspectives de lutte biologique. Rev. For. Fr., XXII, n° spécial: « Lutte biologique en forêt. » DEMOLIN G., 1978 Action du Dimilin sur les chenilles de Lymantria dispar L.: Incidence sur les tachinaires endoparasites. Ann. Sc. For., 35 (3), pp.: 229-234. DU MERLE P., 1971 Sur quelques facteurs qui régissent l’efficacité de Villa brunnea Beck. ( Diptère, Bombylidae ) dans la régulation des population de Thaumetopoea pityocampa Schiff. ( Lepidoptera, Thaumetopoeidae ) Ann. Ecol. Anim. n° hors série « Lutte biologique en forêt » pp.: 55-66. GACHI M. & al. Note sur la présence en Algérie de la processionnaire du cèdre Thaumetopoea bonjeani ( POWEL) (Lepidoptera, Thaumetopoeidae ) Ann. Rech. Forest. en Algérie 1 pp.: 53-63. GACHI M., 1996 La chenille processionnaire du pin Thaumetopoea pityocampa Schiff. Conférence Journée d’étude en protection des forêts C.F.A.T.S.- Jijel. 17 pp. GERI C., 1984 Répartition et évolution des populations de la processionnaire du pin Thaumetopoea pityocampa Schiff. (Lep., Thaumetopoeidae. ) dans les montagnes corses. I. - Régimes d’apparition de l’insecte et dynamique des populations.. Oecol. Applic. 4 (3), pp.: 247-268. GERI C., 1984 Répartition et évolution des populations de la processionnaire du pin Thaumetopoea pityocampa Schiff. (Lep., Thaumetopoeidae. ) dans les montagnes corses. II. -Relations entre les populations et le milieu physique et forestier. Oecol. Applic. 5 (1), pp.: 3-22. GERI C., et MILLIER C., 1985 Mesure des populations de processionnaire du pin de Thaumetopoea pityocampa Schiff. - Lepidoptera, Thaumetopoeidae au Mont Ventoux. Ann. Sc. For., 42 (2), pp.: 143-184. GRISON P., 1970 La lutte biologique en forêt. Rev. For. Fr., XXII, n° spécial: « Lutte biologique en forêt. » QUESTIENNE P., et MIERMONT Y., 1978. Contribution à la connaissance de Thaumetopoea pityocampa Schiff. Étude de la chenille processionnaire du pin et du cèdre au Maroc Ann. Rev. Maroc, Mai 1978. pp : 151-233. RABASSE J.M., 1967 Évaluation de la réduction de la croissance des pins provoquée de la processionnaire (Thaumetopoea pityocampa Schiff.). Note technique, INRF, Tunisie. ROBREDO F., 1987 Consultation entomologique sur la processionnaire du pin. Traitement aérien U.L.V. Rapport F.A.O./PNUD n° ALG/l3/013 ALGÉRIE. Protection phytosanitaire des forêts. |
||||||||||||